近日,国家纳米科学中心丁宝全课题组、施兴华、王会课题组和北京化工大学王振刚课题组、清华大学刘冬生教授合作,在生物分子自组装催化领域取得新进展。相关研究成果以“Cofactor-free oxidase-mimetic nanomaterials from self-assembled histidine-rich peptides”为题目在线发表于《自然-材料》杂志上(Nature Materials,2020,DOI: 10.1038/s41563-020-00856-6)。
天然的氧化还原酶(如过氧化物酶、漆酶、葡萄糖氧化酶等)主要依赖活性位点附近精确排布的氨基酸残基和辅因子(Cofactor)相互协作高效地催化底物的氧化还原反应,其中辅因子对于电子传递起着关键的作用。但是,在环境升温或pH波动时,随着多肽链的解折叠,反应性氨基酸残基的空间排布发生改变,导致辅因子的移位、脱落甚至聚集,从而使酶不可逆地失活。
丁宝全课题组在自组装生物分子的功能化方面已经取得一系列进展(Angew. Chem. Int. Ed., 2018, 57, 15486; Nature Biotechnol., 2018, 3, 258; Nature Mater., 2020, DOI: 10.1038/s41563-020-0793-6)。基于酶催化原理和结构特点发展起来的超分子自组装为酶的从头设计与构造提供了有效的途径,作者在前期工作中通过DNA/多肽/多糖分子自组装构建了辅因子依赖性的类酶活性位点(Chem. Eur. J. 2019, 25, 12576-12582; ACS Catal. 2018, 8, 7016–7024; ACS Nano 2017, 11, 7251-7258.)。对于辅因子依赖的氧化酶或模拟酶而言,其是否能在缺乏辅因子的情况下,仅依靠分子组装和氨基酸残基的协作而实现催化功能,尚未可知。
自组装纳米材料
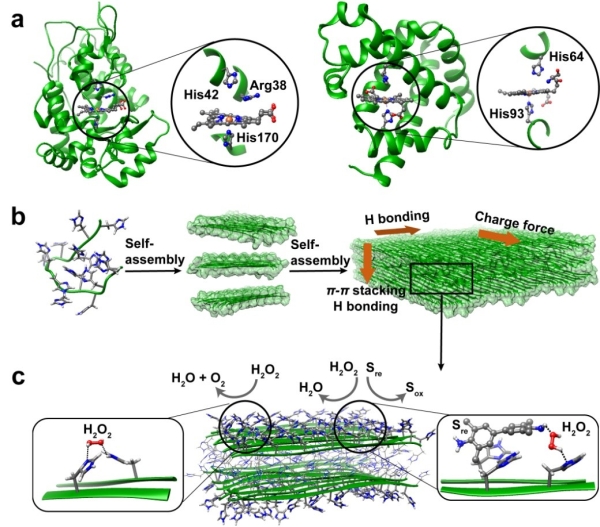
图1.示意图:a)辣根过氧化物酶(左侧)和抹香鲸肌红蛋白(右侧)活性中心结构;b)聚组氨酸多肽自组装过程;c)聚组氨酸多肽自组装结构催化模式。
自组装纳米材料
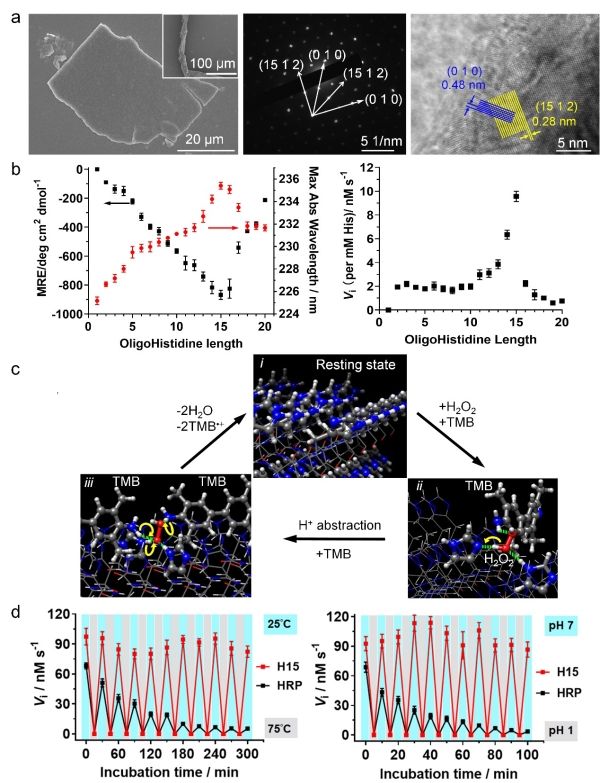
图2.a)十五肽自组装结构的扫描电镜图(inset为带状结构)、电子衍射图和高分辨电镜图;b)聚组氨酸肽的二级结构、活力与分子链长的定量关系;c)聚组氨酸多肽催化过程的理论模型;d)多肽催化剂(十五肽,H15)与天然过氧化物酶(HRP)活力对热处理和酸处理的响应性。
血红素蛋白是一类以血红素(铁原卟啉)为辅因子的蛋白。在过氧化物酶、血红蛋白或一系列血红素模拟酶活性位点中,组氨酸残基作为配体或者酸碱催化剂,能够显著提升血红素的催化活性。考虑到组氨酸侧链咪唑的特性,作者设计了不同长度的聚组氨酸肽(最短为二肽),以COO-和NH3+为末端,通过氢键、电荷或者π-π堆积作用,组装形成了可至毫米级别的大尺寸片状单晶或者带状结构;在不含有血红素辅因子及金属时,表现出显著的催化H2O2氧化四甲基联苯胺(TMB)、高香草基酸(HVA)或烟酰胺腺嘌呤二核苷酸(NADH)的活力。作者系统考察了自组装催化剂的结构和催化功能,发现聚组氨酸肽β-sheet二级结构(贡献氢键作用)、末端基团(贡献静电作用)、侧链咪唑(贡献π-π堆积和氢键作用)协同促进多肽链规整排列,形成晶体结构,后者决定了自组装材料的比催化活力(Vi per His),表明活力与组装的密切关系。ICP-MASS、EDTA与金属/I-添加实验表明,催化剂的活力并非源于痕量金属或者I-。催化动力学、电子顺磁共振波谱和理论计算结果表明,催化剂通过(010)晶面的组氨酸残基、以多重非共价相互作用吸附H2O2和TMB形成三元复合物,通过夺氢反应、超氧自由基OOH.形成、质子转移反应,生成水和TMB阳离子自由基,最后回到初始态。经历10次乃至数百次的加热/冷却或者酸化/中和循环后,该催化剂的活力没有损失。而且活力的响应性变化与组装结构的解离、重构对应,进一步证明活力与组装的关联;但是,含有血红素的天然酶或者模拟酶在经过十个循环处理后,活力均降低80%以上。作者进一步将成纤多肽与聚组氨酸多肽化学偶连,引导聚组氨酸形成纤维状结构,提高催化剂的比表面积使更多的组氨酸残基暴露于表面,能够将TOF (turnover frequency)提高一个数量级。这项发现有望对设计先进的仿生催化材料提供新的思路。这些无辅因子的超分子催化材料也为原始酶提供了一种可能的假想模型;在生命起源前的复杂环境里,无辅因子的多肽组装结构经过多次失活和活化将仍然可能发挥催化功能。
国家纳米科学中心的刘清博士和博士研究生万铠玮为该论文的共同第一作者,北京化工大学的王振刚教授、国家纳米科学中心的王会副研究员和丁宝全研究员为该论文的共同通讯作者。该研究得到了国家自然科学基金、北京化工大学中央高校基本科研业务费、北京市科技计划、中科院战略性先导科技专项及前沿科学重点研究计划、科技部重点研发计划等项目的支持。
论文链接:https://www.nature.com/articles/s41563-020-00856-6。
文章来源:国家纳米科学中心
丁宝全, 2000年毕业于吉林大学化学系获学士学位。2006年9月在美国纽约大学化学系获博士学位,导师Nadrian C. Seeman 教授。其后在美国劳伦斯伯克利国家试验室进行博士后研究,合作者为 Jeffrey Bokor 教授。2009年10月到2010年10月在亚利桑那州立大学作研究助理教授,合作者Hao Yan教授。2010年11月进入国家纳米科学中心,被聘为“百人计划”研究员,博士生导师。
王振刚,北京化工大学教授。分别于大连理工大学化工学院和浙江大学高分子科学与工程系获得学士和博士学位;随后在以色列希伯来大学从事博士后研究;2011年5月加入国家纳米科学中心,历任副研究员和特聘研究员,2019年1月入职北京化工大学材料科学与工程学院,担任教授、课题组长。入选中国科学院青年创新促进会会员,曾获中国科学院卢嘉锡青年人才奖等奖项。以第一或通讯作者在PNAS、Angew. Chem. Int. Ed.、Nano Lett.、ACS NANO等学术期刊上发表论文30篇(IF > 9论文17篇),在多个国内、国际学术会议上做邀请报告。
| 